はじめに
化学を学ぶ上で、モル(mol)の計算ほど重要なものはありません。
しかしながら、
モル(mol)の計算ができず、化学が嫌いになってしまった
という人もいらっしゃるのではないのでしょうか。
化学が苦手な人にとって天敵ともいえるモル計算、
これだけは知っておきたい、
モル(mol)の計算ができるようになるポイントをまとめてみたいと思います。
モル計算図
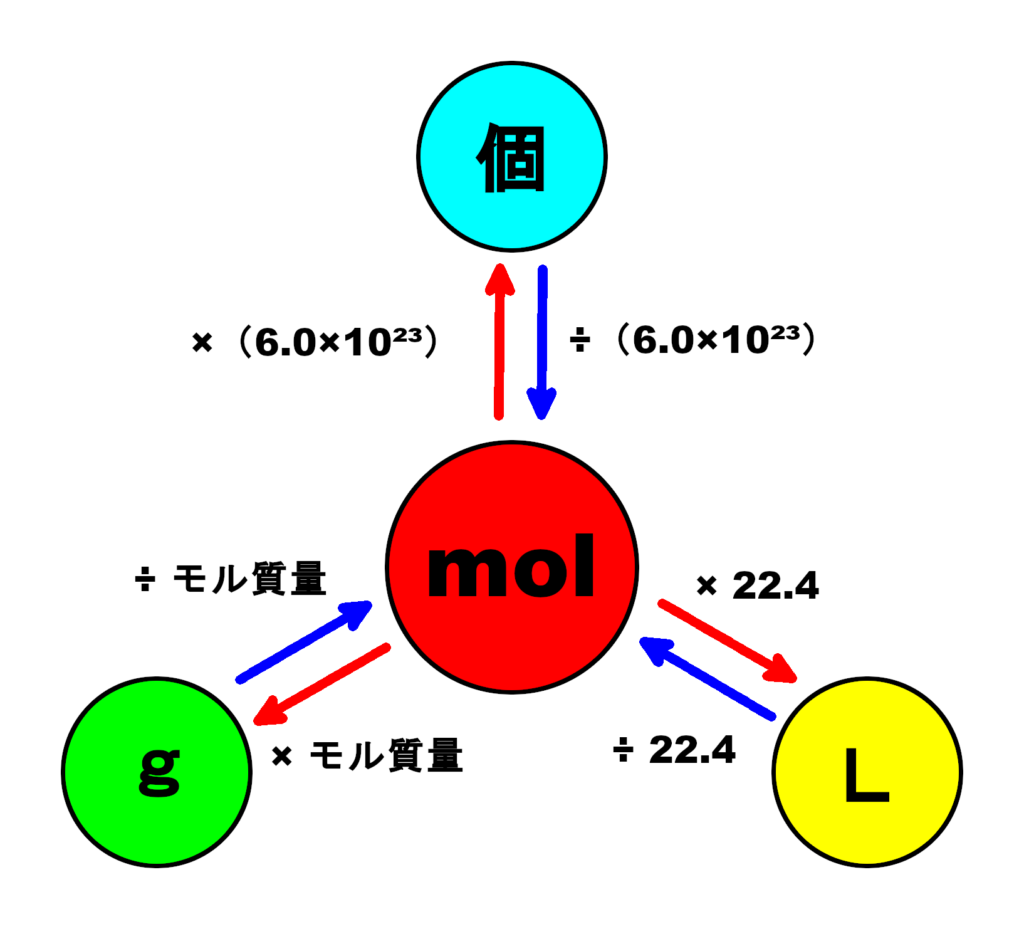
重要なのが、ここで図示した「モル計算図」です。
モル(mol)の計算で出てくる物質量(モル、mol)、粒子の数(個)、質量(g)、気体の体積(L)の4つについて、計算方法をまとめたものです。
「モル計算図」を参考にしながら、次の<基本編><応用編>を見ていきましょう。
基本編・・・まずはこの2つ
モルの計算をする上で重要なのが次の2つです。
個、g、Lからmolを求める
「モル計算図」の青い矢印に注目します。
割り算で求めることができます。
粒子の数(個)、質量(g)、気体の体積(L)の求め方は、それぞれ次のようになります。
粒子の数(個)
÷(6.0×1023)で求めます。
例題:3.0×1023個の二酸化炭素の物質量は何molか。
計算:(3.0×1023)÷(6.0×1023)=0.5mol
*アボガドロ数を6.0×1023としています。
質量(g)
÷モル質量で求めます。
例題:11.0gのプロパン(C3H8、分子量44)がある。このプロパンの物質量[mol]を求めよ。
計算:11.0÷44=0.25mol
*モル質量とは、原子量や分子量など、1molの質量のことです。
気体の体積(L)
÷22.4で求めます。(標準状態における気体1molの体積は22.4Lです。)
例題:標準状態で11.2Lの酸素は何molか。
計算:11.2÷22.4=0.075mol
molから個、g、Lを求める
「モル計算図」の赤い矢印に注目します。
かけ算で求めることができます。
粒子の数(個)
×(6.0×1023)で求めます。
例題:アルミニウム0.1mol中には何個の原子が含まれているか。
計算:0.1×(6.0×1023)=6.0×1022個
質量(g)
×モル質量で求めます。
例題:メタン(CH4、分子量16)0.10molは何gか。
計算:0.1×16=1.6g
気体の体積(L)
×22.4で求めます。
例題:アンモニア0.20molの体積は[ ]Lである。
計算:0.20×22.4=4.48L
応用編・・・これができれば大丈夫
先ほどの<基本編>の(1)と(2)を組み合わせることで、求めることができます。
例題1
例題:3.0×1022個の二酸化炭素(CO2:分子量44)は何gか。
この例題では、問題文中にmolが含まれておらず、
個からgを求める問題となっています。
(これが<基本編>との大きな違いです。)
モル計算図を見ると、
個とgは矢印でつながっていません。
このため、一度molを経由します。(重要)
流れとしては、個→mol→gとなります。
まず、<基本編>の(1)により、
3.0×1022個の二酸化炭素が何molか、を求めます。
途中計算:(3.0×1022)÷(6.0×1023)=0.05mol
続いて、<基本編>の(2)により、
0.05molの二酸化炭素(CO2:分子量44)は何gか、を求めます。
途中計算:0.05×44=2.2g
これより、求める答えは2.2gとなります。
例題2
もう1つ例題を見てみます。
例題:窒素(N2:分子量28)7.0gは標準状態で何Lか。
問題を解く流れとしては、g→mol→Lです。
<基本編>の(1)により、gからmolを求めると、
7.0÷28=0.25mol
<基本編>の(2)により、molからLを求めると、
0.25×22.4=5.6L
これより、求める答えは5.6Lとなります。
まとめ
モルの計算が苦手でどうにかしたい、という方は
ここでまとめた<基本編>の2つを見ながら問題を解いてみてください。
(頭の中だけで計算するのではなく)実際に途中計算を書くことで、
次第に苦手意識が薄れてきます。
化学基礎 最大の難所、ぜひ突破しましょう。

コメント